
국내 연구진이 재발과 전이가 잦아 치료가 쉽지 않은 다발성 골수종(혈액암)과 두경부암의 단백질 표적 치료제와 바이오마커를 개발할 수 있는 새로운 가능성을 열어 기대된다.
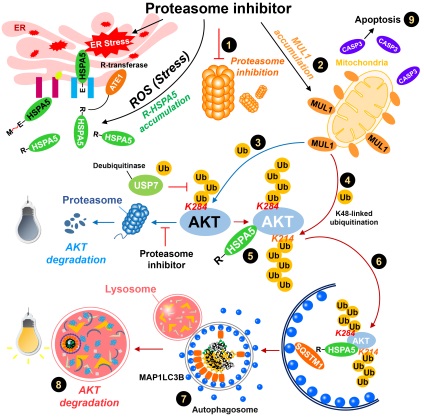
아주대병원 이비인후과 김철호 교수 연구팀은 프로테아좀 (proteasome)이 억제된 세포에서 MUL1 단백질에 의해 특정 발암단백질이 자가포식(autophagy)으로 분해되는 ‘암세포의 세포사멸 기전’을 국내 최초로 규명하는데 성공했다.
다발성 골수종의 대표적인 치료제로 쓰이고 있는 프로테아좀 억제제는 세포 내 단백질을 분해하는 프로테아좀을 억제하여 정상세포 보다 세포분열 속도가 빠른 암세포의 성장을 막고 사멸을 유도해 항암효과를 보인다.
그러나 프로테아좀 억제제로 치료받은 환자에서 다양한 내성이 생겨 재발이 발생했을 경우 치료에 실패하는 일이 빈번하게 발생되고 있다. 최근에는 프로테아좀 억제제 내성을 극복하기 위한 병용치료제 연구가 새로운 연구 분야로 각광받고 있다.
김철호 교수 연구팀은 이번 연구를 통해 암세포 증식, 생존과 재발에 중요한 신호전달체인 AKT 단백질이 프로테아좀이 억제되었을 때 MUL1 단백질로 인해 자가포식 분해되는 사실을 확인했다. 뿐만 아니라 프로테아좀 억제제 내성을 가진 다발성 골수종 세포에서 MUL1 단백질의 발현을 높이면 암세포의 세포주기가 정지되고 세포 사멸이 유도되는 것을 발견했다. 연구팀은 이번 연구 결과를 바탕으로 MUL1 단백질을 조절하는 약물이 개발되면, 현재 문제가 되는 항암제 내성 혹은 재발된 다발성 골수종환자의 치료에 크게 도움이 될 것으로 기대하고 있다.
또한 연구팀은 MUL1 단백질이 종양의 예후와 치료의 바이오마커로서 적용 가능한지 확인하기 위해 아주대병원 종양혈액내과(박준성 교수, 정성현 교수, 최용원 교수)와 협업하여 추가 연구를 진행했다. 이주대병원에 내원한 다발성 골수종 환자 10명의 골수를 분리한 세포에서 MUL1 단백질이 현저히 감소되어 있는 반면 AKT 단백질의 양과 활성이 증가됨을 확인했다. 이는 본 연구팀의 선행연구결과(2018, Autophagy)와 같이 고려할 때 암세포 내에 MUL1의 억제되면 암성장이 촉진되고, MUL1의 발현이 증가되면 암성장이 억제되는 효과가 있어 암진행에 대한 위험성을 미리 알 수 있는 ‘바이오마커’로 활용될 수 있음을 시사했다.
김철호 교수는 “이번 연구를 통해 MUL1의 신규 ‘단백질 분해 메커니즘’을 규명함으로써, 항암제 내성을 극복할 수 있는 이론적 근거가 되었고, 바이오마커로서의 가치를 확인했다”고 말하며, “향후 MUL1 단백질 표적 조절제 연구를 통해 암 내성 극복을 위한 효과적인 병합치료제 개발로 이어져 암 치료에 크게 기여할 것으로 전망하고 있다”고 밝혔다.
한편, 이번 연구는 과학기술정보통신부 · 한국연구재단 개인연구지원사업 (중견연구) 지원으로 수행되었으며, 연구 결과는 ‘Crosstalk between HSPA5 arginylation and sequential ubiquitination leads to AKT degradation through autophagy flux’이란 제목으로 2020년 3월 13일자 생물학 분야 국제학술지 오토파지 (Autophagy) 온라인판에 게재되었다.

