1. 골의 형성과 재형성
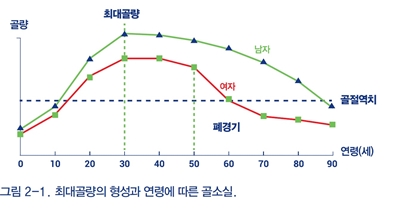
20대 중반에서 30대 초반의 청장년 시기에 최대골량이 형성되고, 이후 골소실이 지속된다. 최대골량이 형성되기 전은 골형성이 골흡수를 능가하는 골모델링(bone modeling) 시기로, 특히 사춘기 전후에 골량 증가가 가장 왕성하다. 30~50세까지는 대체로 골량이 유지되며 소량의 감소만 관찰되는데, 이는 낡은 뼈를 제거하는 골흡수와 새로운 뼈를 만드는 골형성이 평형을 이루기 때문이다. 여성의 경우 급격한 폐경후 골소실이 관찰된다(그림 2-1).
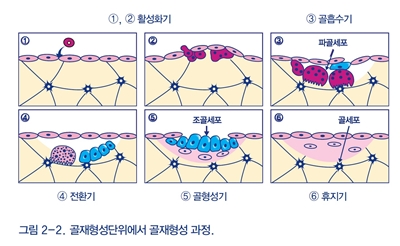
골흡수와 골형성이 순차적으로 발생하여 골항상성을 유지하려는 현상을 골재형성(bone remodeling)이라 한다. 골재형성은 약 3~4주에 걸친 파골세포의 골흡수로 시작되어 수개월 진행되는 조골세포의 골형성으로 마무리되는 일련의 커플링 과정이다. 골재형성이 진행되는 부위를 골재 형성단위(BRU) 또는 다세포단위(BMU)라 명명하며, 성인의 경우 약 백만 군데의 골재형성단위가 동시다발적으로 존재한다(그림 2-2)
2. 골재형성의 조절 기전
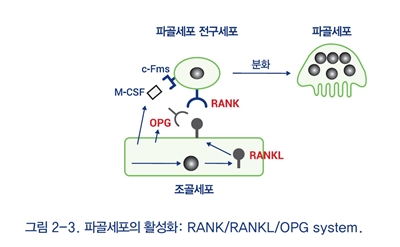
성숙한 파골세포는 3~20개의 핵을 가진 다핵세포로서 조혈모세포로부터 기원한다. 활성화된 파골세포는 세포구조가 편향 배치되어 주름경계(ruffled border)를 형성하고 골표면에 밀착 접촉하여 강력한 골용해물을 분비한다. 파골세포 특이적으로 생성, 분비되는 골단백 용해효소인 cathepsin K에 대한 억제제가 신약으로 개발이 시도되기도 하였다. 파골세포의 분화, 활성화, 사멸의 과정은 비교적 상세히 밝혀져 있다. 조골세포 또는 활성화된 면역세포에서 생성, 분비되는 시토카인인 RANKL는 파골세포와 파골전구세포에 위치한 수용체(RANK)와 결합하여 파골세포의 분화와 활성을 촉진하는 결정적인 역할을 한다. 특이하게 RANKL에 대한 생체길항제인 OPG가 존재하며, 이와 유사한 합성길항제를 이용한 골흡수억제제 개발이 진행되고 있고 RANKL에 대한 항체인 denosumab이 골흡수억제제로 개발되었다(그림 2-3).
조골세포는 중간엽간세포(mesenchymal stem cell)에서 분화되며, 활성화된 파골세포에 의하여 골흡수가 시작된 골재형성 부위에 수많은 활동성 조골세포가 모여 골기질을 생성한다. 점차 골기질에 무기질이 침착되면서 골형성이 마무리되는데, 이후 조골세포의 약 70% 이상은 세포자멸사하고 일부는 골세포와 골표면세포로 분화되어 장기간 생존한다. 조골세포의 증식, 분화, 세포사멸에 대한 연구는 파골세포만큼 잘 알려져 있지 않다. 조골세포로 분화를 유도하는 국소신호전달체계인 BMP, Wnt, RUNX-2, osterix 등과 전신조절인자인 성호르몬, 칼슘친화성 호르몬(calciotropic hormone), 교감신경계, 성장호르몬/IGF-1 등이 연구되고 있다.
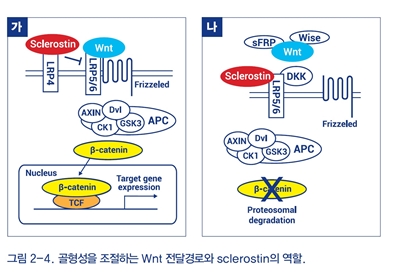
골세포는 뼛속 깊이 매몰되어 있는 비활동성 휴지기 세포로 간주해 왔다. 그러나, SOST 유전자를 통해 발현되는 sclerostin이 발견됨에 따라 골세포가 내압감지자(mechanosensor)로서 골재형성 조절에 중추적인 역할을 한다는 것이 밝혀지고 있다. 골세포에서 대부분 발현되는 sclerostin을 억제하면 Wnt 전달경로에 의한 골형성이 유도되며, 골형성촉 진제인 부갑상선호르몬을 간헐적으로 투여하면 sclerostin이 억제된다(그림 2-4). 이외에도 골세포는 성숙단계에 따라 PHEX, MEPE, DMP1, FGF23 등의 물질을 생성하여 칼슘, 인의 대사를 조절하고 골기질의 형성에 관여한다.
골재형성은 파골세포, 조골세포, 골세포의 직접 접촉 또는 전달물질을 통한 상호소통으로 균형을 이룬다. 또한 T림프구, B림프구 등 면역세포, 교감신경계, 지방세포, 조혈모세포, 혈관내피세포 등도 골재형성의 조절에 영향을 미치는 것으로 연구되고 있다.
3. 성호르몬의 중추적 역할
골대사에 미치는 여성호르몬의 중추적 역할은 폐경 또는 난소절제 후 유발되는 급격한 골소실이 에스트로겐 투여로 예방된다는 사실을 통해 오래 전부터 입증되어 왔다. 에스트로겐은 여성뿐만 아니라 남성에서도 가장 중요한 골대사 조절호르몬이다. 에스트로겐 수용체 또는 안드로겐을 에스트로겐으로 전환하는 아로마타제(aromatase)의 선천성 결핍이 있는 남성 골다공증의 증례와 다수의 역학연구가 남성의 골형성, 유지에 에스트로겐의 결정적인 역할을 증명한다.
에스트로겐 결핍은 파골세포의 수와 생존기간을 늘리고 골재형성단위의 수와 깊이를 증가시키는 반면 조골세포의 경우 수는 증가하지만 조기 사멸되어 결과적으로 골형성이 골흡수에 미치지 못하기 때문으로 밝혀졌다. 에스트로겐 수용체를 파골세포 특이적으로 제거하면 세포자멸사가 감소하고 골소실이 증가한다는 실험이 발표되면서 에스트로겐의 파골세포에 대한 직접 작용이 입증되었다. 면역세포와 시토카인을 매개한 에스트로겐의 역할에 대한 수많은 연구가 있었으며, 최근 에스트로겐 결핍에 의한 조골세포의 NF-κB 증가, 에스트로겐의 산화스트레스 억제작용 등이 발표되고 있으나 조골세포와 골형성에 미치는 에스트로겐의 작용기전은 아직 불확실하다.
에스트로겐은 골내막 골성장(endosteal bone apposition)을 촉진한다.
반면 남성에서 안드로겐은 골피질 골팽창(periosteal bone expansion)을 촉진하여 반경이 큰 뼈를 만드는데, 이 과정에서 안드로겐 수용체뿐만 아니라 에스트로겐 수용체 알파도 관여하는 것으로 연구되고 있다.
4. 노화와 골다공증
노화가 진행되면 소주골(trabecular bone)과 피질골(cortical bone)의 기하학적 구조가 변형된다. 소주골은 두께와 숫자가 감소하여 사이 공간이 넓어지고 골량이 감소한다. 피질골은 골내막 흡수가 증가하고, 보상반응으로 골피질 형성이 증가하여 내경은 커지지만 피질골의 두께는 감소한다. 장기추적 역학연구를 통해 연령에 따른 골소실은 최대골량 형성 직후인 20대부터 이미 시작되는 것으로 보고 있다.
노화로 인해 골세포의 세포자멸사가 증가하여 골세포의 수가 급감하고 골세포가 위치하던 소와(lacuna)의 무기질 침착으로 인한 미세골 경화 현상이 보고되었다. 따라서, 뼈에 가해지는 스트레스나 손상에 대한 내압감지능이 떨어지면서 원활한 골재형성이 안 되고 미세균열과 미세골절을 일으켜 골량뿐만 아니라 뼈의 질이 감소한다.
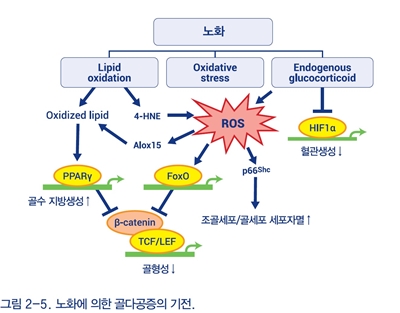
노화에 따라 TNF-α, IL-1β, 유도형 NO 생성효소 등 전염증성 표지자와 활성산소종, 산화지방 등 산화스트레스를 반증하는 표지자의 증가가 관찰된다. 전염증성 표지자는 면역세포와 연계하여 파골세포를 자극하며, 이러한 골소실 기전은 골면역학 영역에서 활발히 연구되고 있다. 산화스트레스는 조골세포에서 Wnt 전달을 방해하고 β-catenin을 TCF가 아닌 FOXO 전사인자에 결합 작용시켜 조골세포 형성을 억제하고 조골세포, 골세포의 생존기간을 감소시키며 파골세포의 분화, 활성, 생존기간은 증가시켜 뼈의 노화를 유발한다. 체내 글루코코르티코이드는 노화에 따른 음성되먹이기 기능저하와 생성, 활성화의 증가로 인하여 혈중 농도가 상승하며, 이는 혈관내막의 산화스트레스를 높이고 혈관수축을 유발하여 뼈의 수분 함량을 감소시키며 골형성을 억제한다(그림 2-5).
5. 유전-환경적 영향
골다공증 발생의 중요한 2가지 위험인자는 성장기의 낮은 최대골량 형성과 빠른 골소실이다. 최대골량 형성은 유전적 요인과 환경적 요인에 의해 결정되지만 유전적 영향이 약 50~90%로 더 크다. 모친의 골밀도가 낮은 경우 딸도 골밀도가 낮을 확률이 높으며 이란성보다 일란성 쌍생아에서 성장 후 골밀도가 서로 유사한 것으로 보고되었다. 유전적 영향은 최대골량의 형성기뿐만 아니라 이후에도 지속된다. 어떠한 유전자의 차이가 골다공증 발생에 관여하는지는 확실치 않으나 골다공증은 다수의 유전적 변이의 상호작용에 따른 ‘다유전자 질환’이다. 최근 유전체 전체를 탐색하는 GWAS (Genome-Wide Association Study)를 이용하여 다수의 유전자 조합을 찾아내고자 노력하고 있다. 17개의 GWAS를 취합한 대규모 메타분석인 GEFOS2 연구에서 골밀도, 골다공증 골절과 연관된 다수의 유전자좌를 밝혔다. 대부분이 RANK-RANKL-OPG, 중간엽줄기세포 분화, Wnt 전달경로에 관계된 유전자들이었으며, 일부는 기능이 알려지지 않은 부위도 발견되어 새로운 연구들이 기대된다.
단일유전자 골질환 가족 구성원 간의 연관분석법을 활용하여 새로운 유전자들이 발굴되고 있다. LRP5 유전자, SOST 유전자의 발견이 성공적인 예로서 이 지식을 토대로 신약들이 개발되고 있다.
후성적(epigenetic) 연구는 환경적 요인이 유전자에 영향을 주는 기전을 설명한다. SOST 유전자의 DNA 메틸화가 골세포 분화를 조절한다는 연구와 골형성을 조절하는 마이크로 RNA에 대한 연구들이 발표되고 있다.
환경적 요인은 칼슘, 비타민D, 단백질 등 영양성분, 신체활동량, 질병이나 약제 사용 등 수많은 요인이 알려져 있다. 흡연은 골다공증 골절의 명백한 위험인자로 연구되고 있으며 에스트로겐 대사를 촉진하여 조기폐경과 에스트로겐 효과 감소의 원인이 된다. 흡연으로 생성되는 발암물질이 조골세포와 파골세포에 영향을 미칠 수 있다는 연구가 보고되고 있다. 하루 30 g 이상의 알코올 섭취가 파골세포의 생성을 촉진하고 조골세포의 증식, 분화를 억제한다고 보고되었으며, 만성적인 음주는 테스토스테론, 에스트로겐 등 성호르몬 감소와 근육량 감소를 유발하는 등 알코올은 다양한 기전으로 골량 감소를 유발할 수 있다.
* 참고문헌
1. Almeida M, et al. Physiol Rev 2017;97:135-87
2. Bonewald LF. Endocrinol Metab Clin North Am 2017;46:1-18
3. Boyce BF, et al. Endocrinol Metab (Seoul) 2015;30:35-44
4. Delgado-Calle J, et al. Bone 2017;96:29-37
5. Estrada K, et al. Nat Genet 2012;44:491-501
6. Farr JN, et al. Nat Rev Endocrinol 2015;11:513-21
7. Husain A, et al. Curr Osteoporos Rep 2017;15:450-8
8. Karsenty G, et al. Nature 2012;481:314-20
9. Okamoto K, et al. Physiol Rev 2017;97:1295-349
10. Rivadeneira F, et al. Trends Endocrinol Metab 2016;27:262-81
<지침 발행 : 대한골대사학회>

