작년 임상시험 진행 사항으로 국내사는 심혈관계 분야, 다국적사는 항암제 분야가 가장 많은 것으로 나타났다.
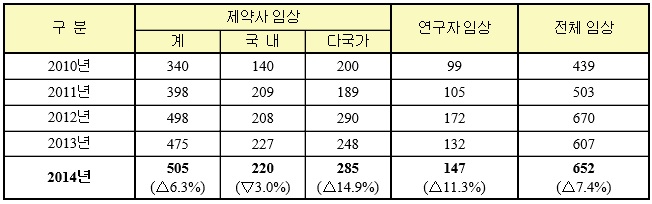
식품의약품안전처(처장 정승)는 2014년 임상시험계획 승인현황을 분석한 결과, 전체 승인건수는 652건으로 2013년의 607건과 비교하여 7.4% 증가했다고 밝혔다.
지난해 국내 제약사의 임상시험 승인건수는 220건으로 2013년(227건) 대비 소폭 줄어들었으나 다국적 제약사의 임상시험 승인이 비교적 크게 늘었다.
지난해 승인된 임상시험은 ▲국내 제약사, 다국적 제약사 1상 임상 지속 증가 ▲효능군으로는 종양, 제제별로는 합성의약품에 집중 ▲국내 제약사 심혈관계 의약품, 다국적 제약사는 항암제 집중 ▲수도권·대형병원 편중 현상 등의 특징을 보였다.
< 국내 제약사, 다국적 제약사 1상 임상 지속 증가 >
국내 제약사의 1상 임상시험(152건)은 2013년(130건) 대비 17% 증가하였다.
이러한 증가세는 최근 국내 제약사들이 복합제 등 개량신약 개발에 성공하면서 임상시험 등 연구·개발(R&D) 비용을 확대한 데 따른 것으로 보인다.
또한 복합제에 대한 임상시험도 2013년 63건에서 2014년 86건으로 36% 증가하였다.
다국적 제약사도 1상 임상시험이 2013년 25건에서 2014년 40건으로 60% 이상 증가하였는데, 이는 임상시험에 필요한 인력과 시설 등의 국내 인프라가 충족되는 등 임상시험 수행능력 향상에 따른 결과로 풀이된다.
< 효능군으로는 종양, 제제별로는 합성의약품에 집중 >
임상시험용 의약품을 효능군 별로 살펴보면 종양(210건), 심혈관계(89건), 중추신경계(58건), 내분비계(55건) 등의 순으로 많았다.
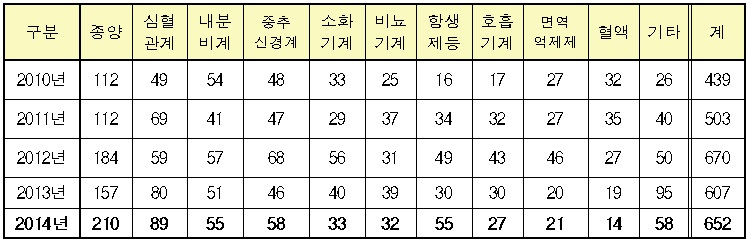
2013년에는 종양(157건), 심혈관계(80건), 내분비계(51건), 중추신경계(46건)의 순이었으며, 상위 4개 효능군 모두에서 건수가 증가했다.
제제별로는 합성의약품이 465건(71%), 바이오의약품 169건(26%), 생약(한약)제제 18건(3%)으로 나타났다.
바이오의약품의 경우 유전자재조합의약품(109건), 세포·유전자치료제(31건), 생물학적제제(29건) 순으로 많았고, 유전자재조합의약품은 2013년(88건) 대비 24% 증가하였다.
< 국내 제약사와 다국적 제약사간 효능별 임상분야 상이 >
국내 제약사의 임상시험 건수는 심혈관계(60건), 내분비계(30건), 종양(20건), 비뇨기계(20건), 중추신경계(17건) 등의 순서다.
이는 급격한 고령화 진입에 따라 국내 제약사들이 고혈압, 고지혈증, 당뇨 등 만성 성인병 치료제 개발에 집중하고 있기 때문인 것으로 분석된다.
반면, 다국적 제약사의 경우 종양(132건), 항생제(25건), 중추신경계(23건), 심혈관계(20건), 내분비계(20건) 등의 순서로 많았으며, 국내 제약사와 효능군 별로 집중하는 분야가 상이했다.
최근 약제 내성을 극복한 표적치료제, 인체 면역기능을 활성화하여 암세포를 사멸시키는 면역 조절 항암제 등 새로운 패러다임의 임상시험이 눈에 띄며, 항암제 임상시험은 2013년(101건) 대비 30% 이상 증가하여 다국적 제약사들이 항암제 개발에 주력하고 있는 것으로 나타났다.
< 제약사, 연구개발 수탁전문기업(CRO)의 임상시험 승인 현황 >
국내 제약사는 한미약품이 18건으로 가장 많았고, 그 뒤로 일동제약(16건), 종근당(12건) 등의 순이었다.
다국적 제약사의 경우 한국노바티스(26건), 한국MSD(18건), 글락소스미스클라인(15건), 한국화이자(14건), 한국베링거인겔하임(13건), 한국아스트라제네카(13건) 등의 순이었다.
연구개발 수탁전문기업(CRO)은 퀸타일즈 트랜스내셔널코리아(31건), 피피디 디벨럽먼트피티이엘티디(15건), 파마수티컬리서치어소시에이츠코리아(15건) 순으로 많았다.
< 지역·기관 편중현상 여전 >
지역별 임상시험실시기관 별로 살펴보면, 서울(1,518건, 53%)과 경기도(466건, 16%)가 약 70%를 차지하였으며, 기타 지역은 부산(181건, 6%), 대구(157건, 5%), 인천(132건, 4%) 등의 순으로 여전히 수도권에 집중되어 있다.
지역별 편차는 수도권에 대형 임상시험실시기관이 많이 위치해 있기 때문으로 보인다.
임상시험실시기관은 서울대학교병원(240건, 8.4%), 삼성서울병원(214건, 7.5%), 서울아산병원(194건, 6.8%), 연세대학교 신촌세브란스병원(192건, 6.7%), 가톨릭대학교 서울성모병원(136건, 4.7%) 등의 순서였고 이들 5개 대형 병원의 점유율은 34%나 되었다.
한편 식약처는 임상시험 대상자의 안전을 강화하기 위해 임상시험참여자가 3개월 이내에 다시 시험에 참여할 수 없도록 하고 ‘대상자 보호프로그램(HRPP)’ 운영 등을 통해 참여자의 안전 관리에 만전을 기하고 있다.
또한, 내년부터 임상시험실시기관에 대한 차등관리제를 도입하기 위해 올해 87개 임상시험실시기관에 대해 수행능력평가를 실시한다.
지난해 36개 기관(우수 17개, 보통 19개), 2013년에는 43개 기관(우수 28개, 보통 15개)에 대해 평가한 바 있다.
식약처는 국내 제약사 등이 체계적이고 효율적인 임상시험을 통해 신약을 개발 할 수 있도록 지속적인 지원을 수행하는 동시에 국제조화 및 품질향상은 물론 임상시험 참여자 안전을 강화할 계획이라고 밝혔다.

